Technologia VissionArray HPV
Wirus HPV został zidentyfikowany, jako główny czynnik ryzyka raka szyjki macicy. Ten typ nowotworu jest jednym z najczęściej występujących nowotworów wśród kobiet na całym świecie. Rocznie szacuje się ok. 530 000 zdiagnozowanych nowych przypadków oraz ok. 280 000 zgonów.
Całościowy system VisionArray HPV służy do detekcji ludzkiego wirusa Papillomavirus i został opracowany przez niemieckiego producenta m. in. sond i odczynników do diagnostyki FISH i CISH - firmę ZytoVision GmbH. Zasada testu opiera się na analizie DNA: izolacji DNA z próbki, reakcji PCR, hybrydyzacji do specjalnie przygotowanej macierzy na szkiełku podstawowym, detekcji chromogennej produktów reakcji i analizie wyników przy pomocy oprogramowania VisionArray Analyzer Software.
Zestaw jest przeznaczony do analizy DNA w materiale utrwalonym w formalinie i zatopionym w parafinie, z cytologii ginekologicznej, z płynnej cytologii (ThinPrep).
Zasada testu:

Izolacja DNA
Pierwszym krokiem jest przygotowanie materiału genetycznego do analizy. W tym celu z próbki należy wyizolować DNA. Służą do tego:
| Nr kat. | Produkt | Ilość testów |
|---|---|---|
| VI-0001-50 | VisionArray FFPE DNA Extraction Kit | 50 |
| VI-0002-50 | VisionArray Cytology DNA Extraction Kit | 50 |
Reakcja PCR
Następnym etapem jest powielenie odpowiednich fragmentów wirusowego DNA w reakcji PCR. Służą do tego odpowiednio przygotowane biotynylowane primery, które znakują różne sekcje regionu L1 genomu HPV.
Kontrolą wewnętrzną reakcji PCR jest amplifikacja ludzkiego genu HLA-DQA1.
Do tego kroku zostały przygotowane następujące produkty:
| Nr kat. | Produkt | Ilość testów |
|---|---|---|
| VP-0001-50 | VisionArray Primer Kit 2.0 | 50 |
| VE-0001-100 | VisionArray PerCise Taq DNA Polymerase | 100 |
| VE-0002-100 | VisionArray Uracil-DNA Glycosylase | 100 |
| ES-0007-50 | VisionArray HPV PerCise Master Mix | 50 |

Hybrydyzacja z macierzą na szkiełku podstawowym
Po amplifikacji materiału genetycznego wyznakowane biotyną sekwencje podlegają hybrydyzacji z komplementarnymi sekwencjami zakotwiczonymi na specjalnym szkiełku (VisionArray HPV Chip 1.0 lub VisionArray HPV High Risk Chip 1.0). Pozytywnym wynikiem reakcji jest uzyskanie produktu o niebieskim zabarwieniu.
Na tym etapie potrzebne będą następujące produkty:
| Nr kat. | Produkt | Ilość testów |
|---|---|---|
| VA-0001-10 | VisionArray HPV Chip 1.0 | 10 |
| VA-0001-50 | VisionArray HPV Chip 1.0 | 50 |
| VA-0002-10 | VisionArray HPV High Risk Chip 1.0 | 10 |
| VA-0002-50 | VisionArray HPV High Risk Chip 1.0 | 50 |
| VK-0003-50 | VisionArray Detection Kit | 50 |
Dostępne są dwa rodzaje macierzy do detekcji typów wirusa HPV: VisionArray HPV Chip 1.0 umożliwia detekcję 41 różnych typów HPV, natomiast VisionArray HPV High Risk Chip 1.0 pozwala na zidentyfikowanie 24 typów wirusa HPV tzw. wysokiego ryzyka.
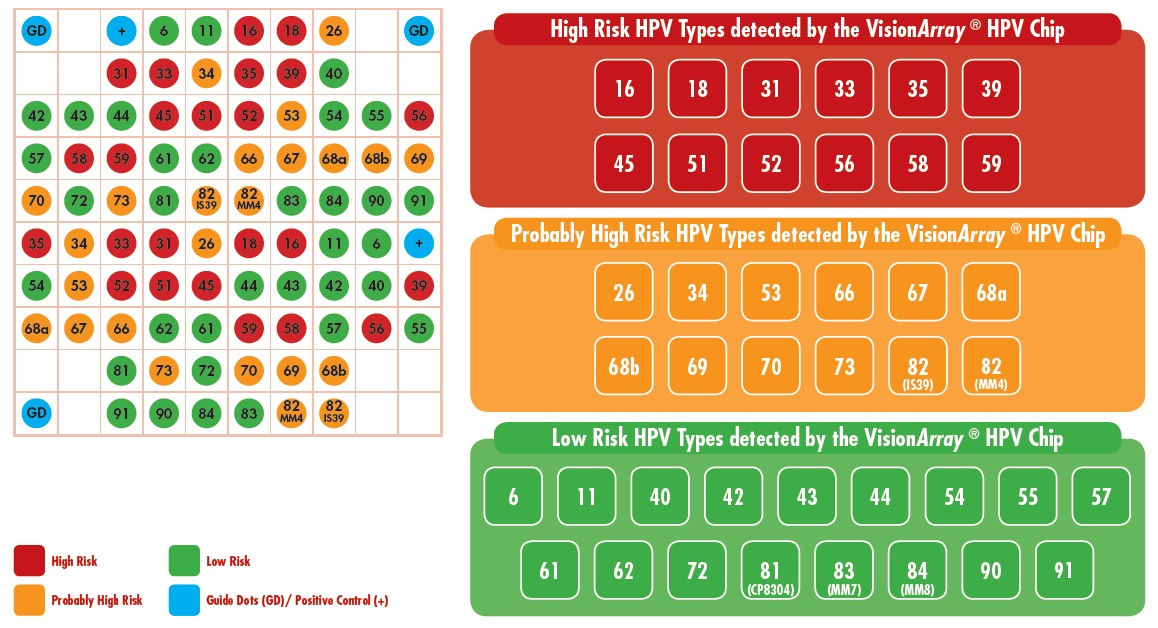
Rozkład komplementarnych nici DNA wirusa HPV na macierzy szkiełka VisionArray HPV Chip 1.0 (VA-0001-10/50)
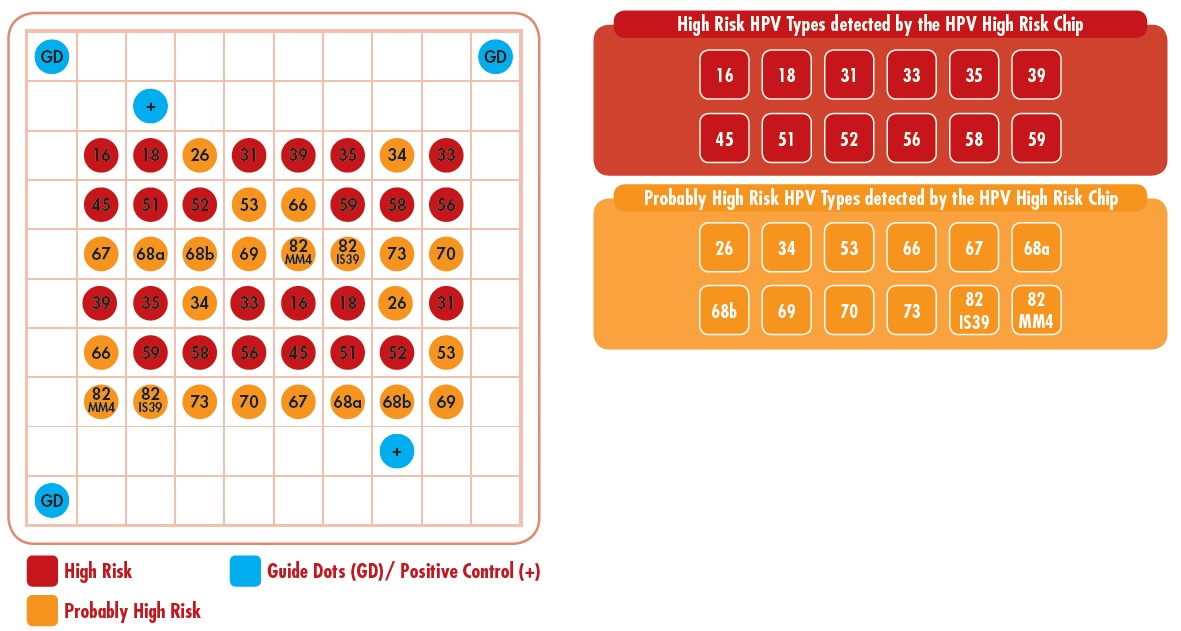
Rozkład komplementarnych nici DNA wirusa HPV na macierzy szkiełka VisionArray HPV High Risk Chip 1.0 (VA-0002-10/50)
Detekcja i analiza
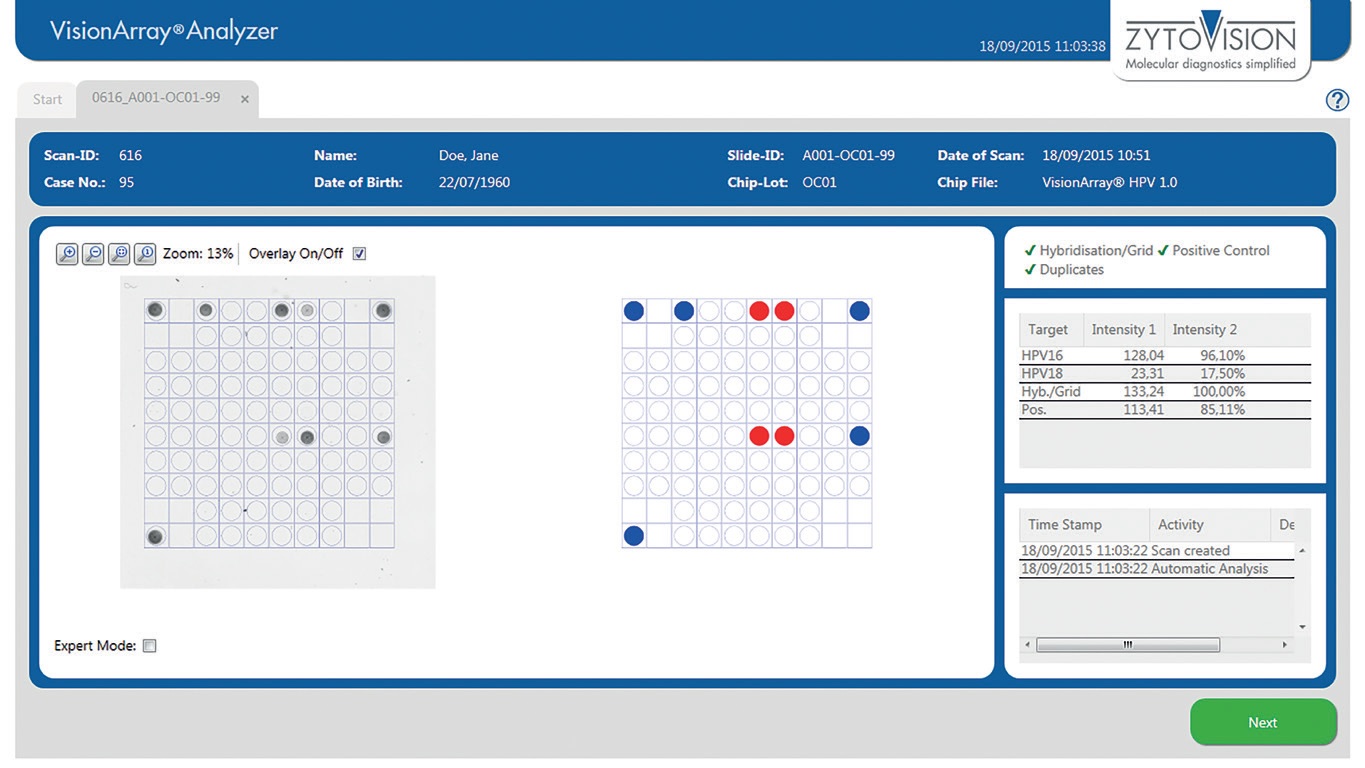
Ostatnim krokiem jest detekcja i analiza uzyskanych wyników, która jest możliwa przy pomocy dedykowanego skanera Scanner 8100 do macierzy na szkiełkach i oprogramowania VisionArray Analizer Software. Zestaw jest dostępny jako komplet pod nr tak. E-4060-1.

VisionArray Analysis Package (E-4060-1)
W wyniku analizy macierzy szkiełka uzyskujemy raport z graficzną i tekstową informacją o typach wirusa HPV obecnego w badanej próbce. W celu ochrony danych raporty mogą być anonimizowane.
Wyniki zewnętrznej kontroli EHEQUAS (Eutropean HPV DNA Test External Quality Assurance Scheme) w turach kwiecień 2016 r. i maj 2017 r.
W programie mogą uczestniczyć europejskie laboratoria wykonujące testy HPV. Po rejestracji uczestnicy otrzymują 5 - 7 próbek do wykrywania wirusa HPV 1 - 2 razy w roku. Uważa się, że uczestnicy powinni mieć możliwość zgłoszenia wyników do koordynatora w ciągu 3 tygodni od otrzymania próbek. Następnie raporty z wyników testów są oceniane przez zespół koordynujący, a wyniki i metody uzyskane od wszystkich uczestników są porównywane.
Wyniki całościowe zewnętrznej kontroli jakości są wydawane i ogłaszane uczestnikom. Udany udział w EHEQAS jest niezwykle pomocny dla laboratoriów do weryfikacji i walidacji uzyskanych wyników.
Kontrola jakości - kwiecień 2016
Do programu przystąpiło 8 laboratoriów. Każde laboratorium otrzymało te same 5 lub 7 próbek EHEQAS (te same wymagania dla wszystkich laboratoriów), które powinny być przeprowadzone przez zastosowanie ich rutynowej metody testowania HPV. Jeśli wszystkie 5 i 7 próbek zostały ocenione pomyślnie, maksymalna możliwa do uzyskania ocena wynosiła odpowiednio 50 i 70.
Dwa laboratoria uzyskały maksymalną ocenę: Genomica HPV 3 i VisionArray ® HPV Chip 1.0 jako metoda testowania HPV.
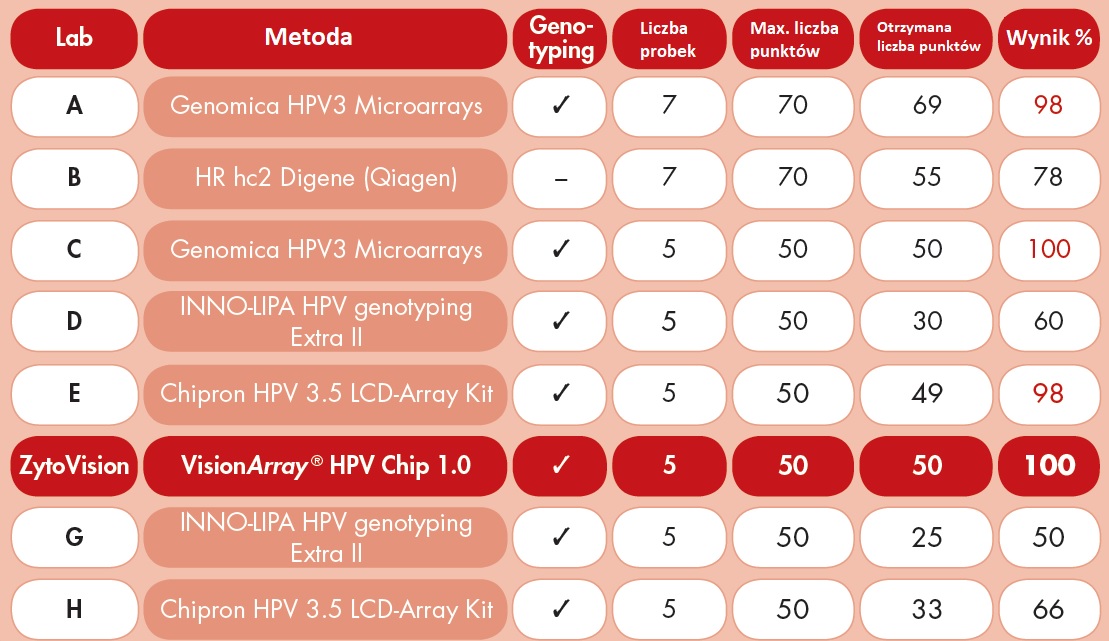
Wniosek: Metoda ZytoVision VisionArray HPV Chip 1.0 została użyta tylko w 1 laboratorium i uzyskała 50 punktów - 100% skuteczności, co stanowiło jeden z najlepszych wyników uzyskanych w całym teście.
Kontrola jakości - maj 2017
W tej edycji testu uczestniczyło 10 laboratoriów. Każde laboratorium otrzymało te same 5 lub 7 próbek EHEQAS (te same wymagania dla wszystkich laboratoriów), które powinny być przeprowadzone przez zastosowanie ich rutynowej metody testowania HPV. Jeśli wszystkie 5 i 7 próbek zostały ocenione pomyślnie, maksymalna możliwa do uzyskania ocena wynosiła odpowiednio 50 i 70. Dwa laboratoria uzyskały maksymalną ocenę: InnoLipa HPV genotyping extra strip assay i VisionArray ® HPV Chip 1.0 jako metoda testowania HPV.
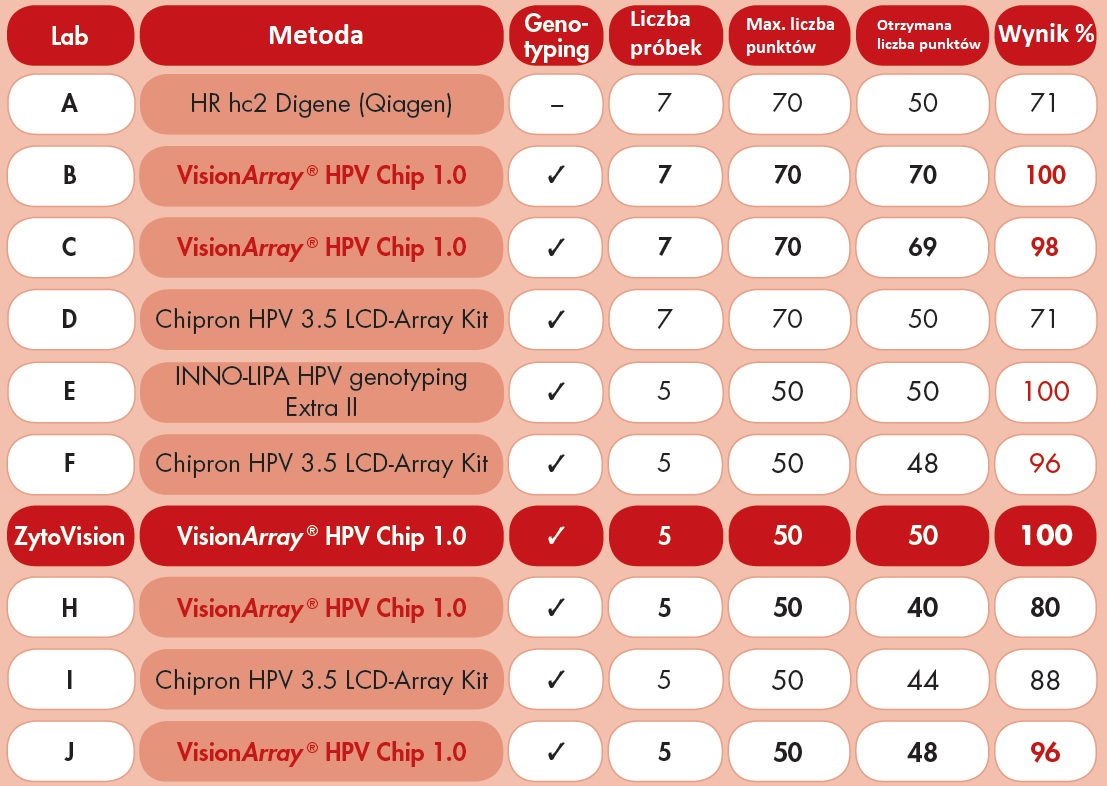
Wniosek: Metoda ZytoVision VisionArray HPV Chip 1.0 została użyta tylko w 5 laboratoriach. Laboratorium ZytoVision uzyskało 50 punktów - 100% skuteczności. Pozostałe 3 laboratoria stosujące metodę VisionArray do testowania uzyskało wyniki ocenione, jako doskonałe (96-100%), wykazując wysoką zdolność i powtarzalność systemu.